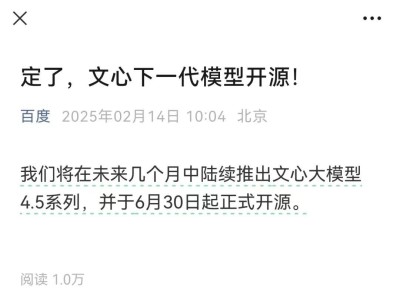
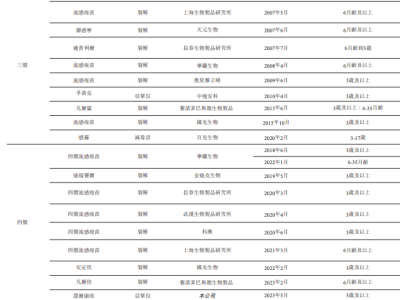
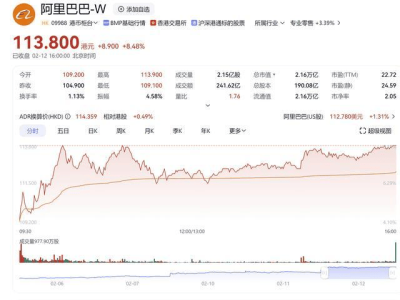
在医疗器械行业,无源医疗器械的注册检测是一个复杂且关键的过程,旨在确保产品安全、有效并符合法规要求。近日,我们深入了解了这一检测流程,发现其涵盖了多个关键检测项目。
首先,物理性能检测是基础中的基础。检测人员会严格检查医疗器械的尺寸和形状,确保它们与设计图纸完全一致。还会测试产品的物理机械性能,如强度、硬度、韧性等,以及成型加工性能,如制备加工、表面处理和灭菌过程等,这些都是确保产品耐用性和实用性的重要因素。
化学性能检测同样不可或缺。通过对医疗器械的化学成分进行分析,可以确保它们不会释放对人体有害的物质。有害物质残留量检测更是重中之重,包括重金属、有害溶出物等的检测,都必须严格控制在安全范围内,以保障患者的健康。

生物相容性检测是无源医疗器械注册检测中的核心环节。这一检测涵盖了细胞毒性测试、致敏测试、刺激或皮内反应测试等多个方面,旨在全面评估医疗器械与人体组织的相容性。全身毒性测试和遗传毒性测试也是必不可少的,它们可以确保医疗器械在使用过程中不会对人体产生有害影响。
性能测试方面,功能性检验和稳定性检验是两大重点。功能性检验旨在确保医疗器械能够满足设计要求和使用需求,而稳定性检验则是检测产品在长时间使用或储存过程中的性能变化。对于具有密封要求的医疗器械,密封性检验更是必不可少,以确保其在使用过程中不会出现泄漏等问题。
包装性能验证同样重要。包装完整性测试可以确保医疗器械在运输和储存过程中不受污染或损坏,而灭菌方法验证则可以确保产品经过灭菌处理后达到无菌要求。灭菌残留物检测也是必不可少的,以确保灭菌过程中不会残留对人体有害的化学物质。

除了上述常规检测项目外,根据医疗器械的具体类型和用途,还可能需要进行其他特殊检测。例如,对于长期植入体内的医疗器械,极限浸提测试可以评估其在极限条件下的化学成分浸出情况,从而确保产品的长期安全性和稳定性。
无源医疗器械的注册检测是一个全面而复杂的过程,涵盖了物理性能、化学性能、生物相容性、性能、包装性能以及特殊检测等多个方面。这些检测项目的实施可以确保医疗器械在安全性、有效性、质量和性能方面符合相关标准和法规要求,为患者提供更安全、更有效的治疗选择。